
https://www.sinotechmachinery.com/products/two-stage-multi-stage-fermenter-10l-100l-automatic-sip/
La producción comercial de proteínas terapéuticas recombinantes típicamente implica el cultivo en suspensión de células de mamífero en biorreactores con volúmenes de hasta 10.000 L. Con avances en ingeniería celular, desarrollo de medios basales y alimentados, e ingeniería de bioprocesos en los últimos 30 años, títulos de expresión ~ 10g/L, densidades de células viables> 3 × 10 ^ 7 células/ml, y la productividad de las células unitarias> 20 pg/célula/día es ahora común. Tales densidades de células altas (potencialmente más altas) aumentan los requisitos de mezcla y aireación y pueden someter a las células a un entorno hostil sujeto a altas tensiones hidrodinámicas. Anteriormente, en esta parte de la serie de cursos de ampliación de biorreactores, esta entrega proporciona una comprensión básica del flujo de fluidos, la mezcla y la transferencia de masa en biorreactores, Y cómo la interacción de estos parámetros crea el entorno en el que existen las células. Esto puede afectar significativamente el crecimiento celular, el metabolismo y la producción de proteínas.
Flujo de fluido en biorreactor:
Los fluidos (líquidos o gases) son sustancias que se deforman continuamente cuando se someten a fuerzas de corte. El cizallamiento causa deformación, un cambio en las posiciones relativas de los componentes fluidos. Esta fuerza debe aplicarse para crear flujo de fluido. Los científicos clasifican los fluidos en función de su densidad y viscosidad
• Compresible (o incompresible): Si su densidad cambia con la presión, los gases son generalmente compresible, los líquidos son incompresibles
• Viscosidad (todos los fluidos tienen una viscosidad finita, que es la causa de la "fricción interna" durante el flujo, o expresada como la resistencia del fluido al Movimiento)
• Newtoniano o no newtoniano, dependiendo de si obedecen La Ley de viscosidad de Newton.
La tensión de cizallamiento se calcula dividiendo la fuerza de cizallamiento ejercida sobre el fluido por el área de la sección transversal donde se aplica la fuerza. Estrictamente hablando, el estrés cortante es una de las dos dinámicas de fluidos básicas, la otra es el "estrés normal". Ambos generalmente se determinan multiplicando la viscosidad por el gradiente de velocidad, siendo la dirección del flujo vertical para el esfuerzo cortante y paralela para el esfuerzo normal. Por lo tanto, para el esfuerzo cortante, el gradiente de velocidad se escribe como dUx/dy y para el estrés normal, el gradiente de velocidad se escribe como dUx/DX, donde U es la velocidad del fluido y x e y representan la dirección de la Fuerza/tensión.
Cuando un fluido fluye a través de una tubería u objeto sólido, la velocidad del fluido cambia según la ubicación. Por ejemplo, se supone que una capa de fluido en contacto con una pared de tubería tiene la misma velocidad que la pared o el objeto sólido (velocidad cero). Debido al movimiento total del fluido, la siguiente capa de fluido hacia adentro tiene una velocidad ligeramente mayor, la capa más adentro tiene una velocidad más rápida, y así sucesivamente. En cada fluido, las partículas se intercambian constantemente entre estas capas, lo que afecta la rapidez con la que fluyen. Las partículas que se mueven de una capa de movimiento lento a una capa más rápida tienen su velocidad reducida; las partículas que se mueven de una capa rápida a una capa más lenta tienen un efecto de aceleración. Por lo tanto, el flujo de fluido crea esfuerzo cortante debido a diferencias de velocidad.
Dependiendo de la velocidad del fluido, el flujo se puede clasificar como laminar o turbulento. Cuando el movimiento total del fluido es lento, las capas adyacentes de fluido se mueven en un movimiento ordenado (más o menos paralelo), llamado flujo laminar. En los fluidos de flujo rápido, las partículas de fluido y los grupos de fluidos a menudo fluyen aleatoriamente y caóticamente a través de las capas en un flujo turbulento.
El Número de Reynolds (Re) es una variable adimensional que se utiliza para describir si el movimiento fluido es laminar o turbulento. La Ecuación 1 calcula Re para el flujo de fluido en una tubería de sección transversal circular:
Re = DUpg/μ, donde D es el diámetro de la tubería, U es la velocidad del fluido y PG y μ son la densidad y la viscosidad del fluido, respectivamente.
Dado que la industria biofarmacéutica está interesada principalmente en el flujo de fluidos enFermentador agitado mecánicamente, El número de Reynolds correspondiente se define por la Ecuación 2:
Rei = Ni Di2pg/μ, donde Ni es la velocidad del impulsor, Di es el diámetro del impulsor y PG y μ son la densidad y la viscosidad del fluido, respectivamente.
Conceptualmente, el número de Reynolds representa la relación entre fuerzas inerciales y fuerzas viscosas. Durante laminarFlujo (Reynolds bajo número de), las fuerzas viscosas dominan y el fluido se mueve lentamente. Sin embargo, a medida que aumenta el número de Reynolds, las fuerzas inerciales se vuelven más dominantes y el flujo pasa de laminar a turbulento, y luego a completamente turbulento a valores de Re suficientemente altos.
Si Re < 2100, el flujo de la tubería es laminar. Para los valores de Re de 2000-4000, se considera que el flujo está en el régimen de transición de laminar a turbulento. Una VEZ QUE Re > 4000, el flujo es completamente turbulento. En un tanque agitado, el valor Re que marca la transición del flujo laminar al turbulento depende de la geometría del tanque y el impulsor.
Turbulencia en biorreactores:
La turbulencia es el régimen de flujo encontrado por las células enBiorreactores de biotecnología... La turbulencia es esencial para una mezcla eficiente (transferencia de masa y calor en el fluido), por lo que lograr condiciones turbulentas en el biorreactor es fundamental para un cultivo exitoso. Como se mencionó anteriormente, el número de Reynolds representa el tiempo durante el cual se desarrolla la turbulencia. A medida que este número aumenta, las fuerzas inerciales comienzan a dominar las fuerzas viscosas en el fluido, superando la tendencia de los efectos viscosos a suprimir las inestabilidades de flujo. Por lo tanto, la turbulencia puede verse como un movimiento de fluido altamente desordenado resultante del crecimiento de inestabilidades en un campo de flujo inicialmente laminar.
La turbulencia es inherentemente muy compleja y nuestra comprensión de ella está lejos de ser completa. El flujo tiene una dirección general, pero además de esto hay movimientos caóticos secundarios superpuestos de partículas de fluido, que causan desviaciones de flujo y generan remolinos de diferentes formas, tamaños, velocidades y direcciones de rotación. Estos movimientos secundarios irregulares en la turbulencia tienen un impacto significativo en la eficiencia de la mezcla, las pérdidas de energía y la intensidad de cizallamiento. La turbulencia forma estructuras de fluidos giratorias llamadas remolinos, que pueden estirarse, fusionarse y romperse. La velocidad del fluido dentro de un remolino sufre grandes cambios de magnitud y dirección en distancias y tiempos relativamente cortos.
Los remolinos de diferentes tamaños ocurren en un flujo turbulento. El tamaño de los remolinos más grandes está limitado por los límites del sistema de flujo. Por lo tanto, el diámetro de los remolinos más grandes de un biorreactor es similar (pero ligeramente menor que) el diámetro de la vasija del reactor. Los remolinos grandes son inestables y dan lugar a remolinos más pequeños, que a su vez dan lugar a remolinos más pequeños, etc. En un biorreactor agitado, la energía de los grandes remolinos proviene del flujo a granel generado por los impulsores, por lo que contienen la mayor parte de la energía cinética turbulenta. Los remolinos más pequeños no pueden mantener el movimiento de rotación y pierden energía como calor debido a los efectos de la viscosidad y la fricción del fluido. Por lo tanto, mantener la turbulencia requiere un suministro continuo de energía para reemplazar la energía perdida como calor.
La dispersión es el proceso de romper el flujo a granel en remolinos más pequeños y más pequeños para facilitar el transporte rápido de material a través del barco. El grado de uniformidad que se puede producir por dispersión está limitado por el tamaño del remolino más pequeño que se forma. Suponiendo turbulencia isotrópica en el recipiente agitado y que el flujo es turbulento (NRei > 104 ), el tamaño del remolino más pequeño es aproximadamente igual a la escala de mezcla de Kolmogorov (λ) o escala de turbulencia, definido por la Ecuación 3:
Λ = (ν3/ε)1/4
Donde λ es la longitud característica del remolino más pequeño, es la viscosidad cinemática del fluido ν, y ε es la velocidad de disipación de energía turbulenta local por unidad de masa del fluido.
En estado estacionario, la tasa promedio de disipación de energía turbulenta en todo el biorreactor es igual a la potencia de entrada al fluido del tanque por el impulsor. Por lo tanto, cuanto mayor sea la entrada de potencia al impulsor, serán los más pequeños remolinos. Dado que λ depende de la viscosidad, para una entrada de energía dada, se generan remolinos más pequeños en medios de baja viscosidad. Para una entrada de energía de 0,1 W/kg (actualmente considerado alto para el cultivo de células animales), se estima que el diámetro mínimo de Foucault λ es de aproximadamente 0,06mm (60 μm). Esto representa la escala de mezcla mínima alcanzable por dispersión en estas condiciones.
La longitud característica (λ) del remolino más pequeño es a menudo un indicador del potencial de daño celular debido al cizallamiento de fluidos. Los experimentos han demostrado que si las entidades biológicas (por ejemplo, células de mamífero) en un biorreactor son más pequeñas que λ, no se producirá daño por cizallamiento a tales entidades. Minow et al. compararon la mezcla y la transferencia de masa en dos Biorreactores de un solo uso 1000 L diferentes. Los autores calcularon la escala de Kolmogorov para el remolino más pequeño presente en cada tipo de biorreactor.
Como se muestra en la Tabla 1, los valores de λ calculados para cada tipo de biorreactor eran cercanos a 80 μm, mucho más grandes que el tamaño de 15 μm del ovario de hámster chino (CHO) células utilizadas en este estudio. Del mismo modo, Godoy-SilvA et al. describieron células CHO que podían soportar una entrada de potencia de ≤ 6000 W/kg. A tasas de disipación de potencia> 300 W/kg, que sigue siendo mucho mayor que la densidad de potencia de los reactores comerciales de cultivo celular, el único efecto observado fue el patrón de glicosilación de la proteína expresada. Pero las células no se vieron afectadas. Aunque estos resultados se aplican solo al sistema estudiado, todavía sugieren que el daño por cizallamiento se ha sobreestimado en las últimas décadas. Nienow llegó a la misma conclusión en dos artículos diferentes. Por lo tanto, es seguro decir que los remolinos de menos de 10-20 μm (más pequeños que el tamaño típico de las células de los mamíferos) tienen muy poca energía cinética turbulenta, mientras que los remolinos más grandes simplemente transportan células en convección.
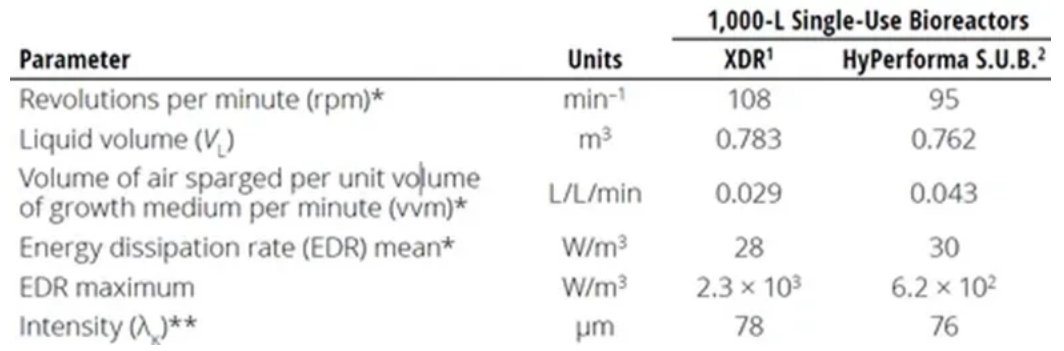
Tabla 1: Comparación de parámetros para calcular la tensión dinámica de fluidos en dos Biorreactores de un solo uso de 1000L diferentes. * Valores máximos en el proceso al tamaño actual del biorreactor ** Calculado a partir de promedios EDR
La mezcla es una operación física que reduce las inhomogeneidades de los fluidos al eliminar los gradientes de temperatura, concentración y otras propiedades. Durante la mezcla, el intercambio de material entre diferentes ubicaciones en un recipiente (por ejemplo, un recipiente de mezcla o biorreactor) da como resultado la “mezcla” de componentes. La mezcla es ampliamente utilizada en El bioprocesamiento, por ejemplo
• Mezclar componentes solubles de medios de cultivo en polvo con agua en preparación para el cultivo celular • Dispersar gases como el aire y el oxígeno a través de un líquido en forma de burbujas • Mantener la suspensión de partículas sólidas como las células o agregados de células (e.g., sobre microvehículos) • Facilitar la transferencia de calor hacia o desde un líquido.
La mezcla es una de las operaciones unitarias más importantes en El bioprocesamiento. No basta con simplemente cargar unBiorreactor fermentadorCon células y medios de cultivo ricos en nutrientes. A menos que el contenido del biorreactor se mezcle bien, las células se asentarán y se formarán zonas de agotamiento de nutrientes a medida que consumen rápidamente las sustancias que necesitan en su entorno local. La mezcla controla el acceso de las células a los nutrientes disueltos y al oxígeno y también juega un papel clave en el control de la temperatura del cultivo. El equipo de mezcla tiene un impacto significativo en la eficiencia de la mezcla, afectando directamente los requisitos de energía y los costos operativos. El desarrollo de la dinámica de fluidos en el medio de cultivo y otros fluidos impulsa procesos de aireación como el colapso de burbujas, el atrapamiento de gas y la dispersión uniforme de burbujas. Por lo tanto, la mezcla puede determinar el éxito de un bioproceso.
Geometría del biorreactor: La mayoría de los Biorreactores grandes de acero inoxidable (o reutilizables) son cilíndricos con una relación altura/diámetro del tanque (H/T) >1. Los deflectores (tiras metálicas cilíndricas) están montados en las paredes del biorreactor para reducir los remolinos y remolinos en el líquido. La mezcla se logra mediante impulsores montados en un eje de agitador central impulsado por un motor. Los impulsores giratorios bombean y obligan al líquido a dispersarse dentro del reactor, creando un patrón de flujo regular que circula a través del recipiente y regresa periódicamente al área del impulsor. Para la aireación, el gas (generalmente aire y/u oxígeno) se introduce en el recipiente a través de un rociador ubicado debajo del impulsor. Para biorreactores cilíndricos, el espacio de cabeza es típicamente 20-30% del volumen total de la vasija.
La forma del fondo del tanque agitado afecta la eficiencia de mezcla. La mayoría de los Biorreactores agitados tienen fondos redondeados en lugar de planos para evitar esquinas afiladas y depresiones en las que puede entrar el flujo de fluido, evitando así la formación de zonas estancadas. La energía necesaria para mantener los sólidos (como las células) suspendidos en un tanque agitado también depende de la forma del fondo del recipiente. Para una mezcla efectiva con un solo impulsor, el diámetro del impulsor (Di) debe estar entre el 0,25 y el 0,50 del diámetro del tanque (T) y la altura del líquido (HL) debe estar entre 1,0 y 1,25 de T. Esto se debe a que la intensidad de la mezcla disminuye rápidamente a medida que el fluido abandona el área del impulsor, por lo que grandes volúmenes de líquido en la parte superior del recipiente (lejos del impulsor) son difíciles de mezclar, por lo que esto debe evitarse. Otro aspecto de la geometría del recipiente que afecta la eficiencia de la mezcla es el espacio (C) entre el impulsor y el fondo del tanque, que afecta la suspensión sólida, la dispersión de gas y la estabilidad hidrodinámica. Para la mayoría de los sistemas de biorreactores de tanque agitado, la relación entre la altura del fluido (C/HL) suele estar en el intervalo de 0,33-0,66.
El tipo Impellor es fundamental para el diseño del biorreactor. El sistema impulsor debe ser capaz de entregar suficiente potencia al medio de cultivo celular para lograr una buena eficiencia de mezcla, uniformidad y transferencia de masa adecuada para satisfacer las demandas de oxígeno de las células. La figura 3 muestra los dos moLos principales diseños de impulsadores comunes que se utilizan en biorreactores reutilizables y de un solo uso: el impulsor Rushton y el impulsor de pala inclinada. A medida que las palas del impulsor giran, empujan contra el fluido adyacente. Esta acción crea áreas de alta presión en la superficie frontal y áreas de baja presión detrás de las cuchillas. Estas áreas son responsables del movimiento de fluidos dentro del biorreactor y, en última instancia, de la mezcla de fluidos. El fluido alejado del impulsor generalmente mantiene una presión constante.
Las palas de lanzamiento y los impulsores Rushton se utilizan comúnmente en biorreactores.
La velocidad del fluido es más alta en la punta de la pala y disminuye rápidamente alejándose del impulsor. A medida que el impulsor gira, crea una velocidad de rotación en el fluido circundante, que se puede observar como una región de Alta Velocidad junto al impulsor. La pala del impulsor de Rushton también induce un flujo radial hacia afuera en las cercanías. Extrae líquido de las regiones superior e inferior del biorreactor, creando un movimiento circular dentro del vaso. Este movimiento mejora la mezcla fluida. Por el contrario, los impulsores de pala inclinada crean principalmente un flujo axial.
El diseño de impulsor preferido para los Biorreactores de cultivo celular es usar cuchillas inclinadas (con un diámetro óptimo de la cuchilla y velocidad de agitación) porque las cuchillas son propensas a sufrir daños por cizallamiento. Los impulsores de pala inclinada crean principalmente flujo axial, pero también pueden equilibrar los patrones de flujo axial y radial si las palas están configuradas adecuadamente.
El flujo axial es necesario para la mezcla de arriba a abajo en Biorreactores de tanque agitados e impulsores de hoja inclinada (donde las cuchillas están en un ángulo de menos de 90 ° con respecto al plano de rotación) puede crear efectivamente este flujo. El fluido que sale del impulsor se conduce hacia abajo hasta que se desvía del fondo del recipiente. Luego, el fluido se esparce y fluye hacia arriba a lo largo de la pared del recipiente antes de ser arrastrado hacia el impulsor. El flujo giratorio requiere que los deflectores rompan los vórtices que se forman a lo largo de las paredes del barco.
Los impulsores de palas de paso, cuando se agitan a velocidades suficientemente altas en medios de baja viscosidad como el agua y los medios de cultivo celular, producen una región turbulenta de alto cizallamiento y mezcla rápida cerca del impulsor. Esta región de Alta cizalladura es responsable del colapso de las burbujas en los Biorreactores que utilizan esparguinces. La energía cinética turbulenta no se distribuye uniformemente por todo el tanque, y los valores más altos ocurren principalmente en la región cercana al impulsor. Los niveles de energía cinética turbulenta en el resto del tanque, lejos del impulsor, son un orden de magnitud más bajos que los valores máximos medidos.
El flujo axial es útil cuando se requiere un flujo vertical fuerte, por ejemplo, para suspender sólidos o células en un fluido. La capacidad de operar impulsores de palas de Paso en modo de flujo ascendente o descendente es un requisito importante, y los motores bidireccionales pueden proporcionar esta capacidad. Para la mayoría de los sistemas de cultivo de células animales, Estos impulsores se establecen en el modo de bombeo ascendente. Sin embargo, la opción de flujo descendente se puede usar para suspender cultivos celulares adherentes en microportadores a bajas velocidades y baja entrada de energía específica para evitar que las células se caigan de los portadores.
Impulsores montados en disco con seis palas rectas, comúnmente conocidas como turbinas Rushton, producen flujo radial. Se utilizan con frecuencia en fermentaciones microbianas porque pueden generar fuerzas de cizallamiento muy altas, proporcionando así una dispersión de gas eficiente. Las turbinas Rushton producen un flujo de líquido de alta velocidad radialmente hacia afuera desde el impulsor hacia la pared del tanque.
El fluido se divide por la mitad, uno fluye hacia arriba y el otro fluye hacia abajo hacia el fondo del tanque. Por consiguiente, el flujo total en el recipiente consiste en dos grandes vórtices anulares, uno por encima del impulsor y el otro por debajo del mismo.
Otra característica de los impulsores de Rushton es que producen un vórtice trasero en el fluido detrás del borde horizontal de cada pala de impulsor plana. Los eddies juegan un papel crucial en la determinación del rendimiento de mezcla, ya que la mayor parte de la mezcla se produce en las proximidades de los vórtices producidos por las palas del impulsor. Estos vórtices posteriores también proporcionan dispersión de gas en sistemas distribuidores de gas. Los gradientes de velocidad pronunciados asociados son una fuente importante de turbulencia. Una de las razones por las que los impulsores de Rushton se utilizan ampliamente en fermentadores microbianos es su capacidad para manejar altos caudales de gas y proporcionar una dispersión de gas eficiente.
La potencia necesaria para lograr una velocidad de agitador determinada depende de la fricción y el arrastre de forma (causado por la diferencia de presión entre la parte delantera y trasera de las palas del impulsor), que resisten la rotación del impulsor. La fricción y el arrastre de forma producen un par en el eje del agitador. La entrada de potencia se puede determinar experimentalmente midiendo el par inducido (Ecuación 4):
P = 2 πNiM
Donde P es Potencia, Ni es la velocidad del impulsor y M es par.
La potencia requerida para mezclar líquidos sin gases depende del agitadorVelocidad, forma y tamaño del impulsor, geometría del tanque y densidad líquida y viscosidad. La relación entre estas variables generalmente se expresa como una potencia adimensional (Ecuación 5):
NP = P/ρNi3Di5
Donde NP es el número de potencia, P es la potencia, Ni es la velocidad del impulsor y Di es el diámetro del impulsor.
El Número de potencia es análogo al coeficiente de arrastre de un sistema agitado. La relación entre NP y Re generalmente se determina experimentalmente para una variedad de configuraciones de impulsor y tanque. Una vez que se vuelve el flujo turbulento, el número de potencia para diferentes diseños de impulsores se vuelve constante. En condiciones turbulentas en tanques agitados, el número de potencia para un impulsor Rushton suele ser constante en 5, mientras que el número de potencia para un impulsor de cuchilla inclinada axial es aproximadamente 1. Por lo tanto, un impulsor Rushton tiene un fuerte arrastre de forma, produce un alto par, Y transmite más potencia a la misma velocidad de funcionamiento en comparación con un impulsor de cuchilla inclinada.
Flujo de fluido: Las palas del impulsor giratorio bombean el fluido en el recipiente del biorreactor. El caudal de volumen del fluido que sale del impulsor es una característica del diseño del impulsor y varía con los parámetros de funcionamiento, como la velocidad del impulsor y el tamaño del impulsor. El Número de flujo adimensional indica la efectividad del proceso de bombeo (Ecuación 6):
Nflow = Q/NiDi3
Donde Q es el caudal de volumen del fluido que sale de las palas del impulsor, Ni es la velocidad del impulsor y Di es el diámetro del impulsor.
Para la misma potencia de entrada, un impulsor de pala inclinada produce casi de 3 a 4 veces el caudal de un impulsor Rushton. Es por eso que se considera que el diseño anterior tiene una alta capacidad de bombeo y eficiencia de operación de mezcla, mientras que se considera que el segundo tiene una menor eficiencia de bombeo.
Para una buena mezcla en un recipiente agitado, la velocidad del fluido que sale del impulsor debe ser suficiente para llevar el material a las zonas más alejadas del recipiente. El fluido circulante también debe barrer a través de todo el recipiente en un período de tiempo razonable. El flujo de fluido debe ser turbulento para lograr una buena mezcla, lo que puede describirse como una combinación de tres procesos físicos (1): Distribución, dispersión y difusión. La distribución también se llama "macromización" y la difusión se denomina "micromixación". La dispersión se puede clasificar como macromixing o micromixing, dependiendo de la escala del movimiento del fluido.
La distribución es el proceso por el cual un fluido es transportado a todas las áreas de un recipiente agitado por el flujo de circulación a granel. Es un proceso importante en el proceso de mezcla y suele ser el paso más lento porque el fluido tiene una larga distancia que recorrer en una larga trayectoria de circulación. La dispersión rompe el flujo a granel en remolinos cada vez más pequeños, lo que ayuda al material a moverse rápidamente a través del recipiente. El grado de uniformidad que se puede producir por dispersión está limitado por el tamaño del remolino más pequeño que se puede formar en un fluido en particular. Para lograr una mezcla más pequeña que el remolino más pequeño, la difusión se convierte en un proceso importante. Esta micromezcla ocurre con relativa rapidez y en distancias más cortas que las involucradas en la distribución.
El tiempo de mezcla (TM) es un parámetro útil para evaluar la velocidad de mezcla global en un recipiente agitado. Es el tiempo necesario para lograr un grado dado de uniformidad a partir de materiales completamente separados. El tiempo de mezcla se puede medir inyectando un material trazador (generalmente una solución de sal ácida, base o concentrada) en el recipiente y rastreando su concentración en un punto fijo en el recipiente.
Cuando se agrega un pequeño pulso trazador a un fluido en un tanque agitado que ya contiene una cierta concentración (Ci) de material trazador, puede esperarse una curva de respuesta de concentración como la de la Figura 6. Se detectan concentraciones relativamente altas cada vez que el flujo a granel lleva el trazador al punto de Medición antes de que se complete la mezcla. El tiempo entre los picos de concentración es aproximadamente igual al tiempo promedio requerido para que el fluido atraviese un bucle de circulación general, llamado tiempo de ciclo (TC). Después de varios ciclos, se logrará la uniformidad deseada.
Después de inyectar el tinte trazador en el tanque agitado, el tiempo de mezcla (TM) se determina basándose en la respuesta de concentración (C); Cf = concentración final, Ci = concentración intermedia, tc = tiempo de ciclo.
El tiempo de mezcla generalmente se expresa como el tiempo en el que la concentración del trazador difiere de su concentración final (Cf) en menos de 5-10% de la diferencia de concentración total (Cf-Ci). En TM, la concentración del trazador es relativamente estable y la composición fluida es casi uniforme. Para los biorreactores a escala industrial, esto toma varios minutos.
La mezcla de fase líquida es crítica en biorea a gran escalaPorque, en la mayoría de los casos, se añaden ingredientes del alimento, bases o agentes antiespumantes en la superficie superior del fluido. Estas adiciones deben distribuirse rápidamente por todo el cultivo para lograr la uniformidad sin inducir gradientes de concentración locales. El proceso de homogeneización se rige por el patrón de flujo dominante y la información sobre las condiciones generales de mezcla en el biorreactor se puede obtener a partir de la medición tm.
Un ESTUDIO SOBRE biorreactor a gran escala
El uso de la técnica de decoloración de yodo fue informado por Sieblist et al. Los datos de la Figura 7 muestran que los patrones de decoloración espacial y las velocidades de decoloración de los diferentes tipos de impulsores varían mucho en la misma entrada de potencia, utilizando tres impulsores Rushton y tres impulsores de pala inclinada. Estos resultados proporcionan evidencia experimental de que los impulsores que inducen el flujo axial pueden reducir tm en aproximadamente un factor de dos. La razón es que los impulsores de pala inclinada que bombean axialmente hacia abajo inducen una estructura de flujo más extensa, lo que mejora significativamente la mezcla de arriba a abajo; el impulsor Rushton provoca regionalización del flujo, dando como resultado una disminución en la eficiencia de mezcla general, por lo que el tiempo de mezcla es más largo.
Tiempo de mezcla (TM) determinado en un biorreactor de 400 L equipado con tres impulsores Rushton (círculos) o tres impulsores de cuchilla inclinada (triángulos); los datos se ajustan a la correlación reportada por Ruszkowski; D = diámetro del impulsor, H = altura del recipiente, T = diámetro del recipiente, Ε = Tasa de disipación de energía turbulenta local por unidad de masa de fluido, 02 95% = tiempo requerido para alcanzar la homogeneidad 95% en el biorreactor.
Un hallazgo sorprendente de este estudio es que el tiempo de mezcla depende solo de la geometría del biorreactor y no del sistema de agitación. Las diferentes configuraciones del impulsor afectan el factor constante (10,5 o 17,9) en la correlación empírica de Ruszkowski. Otro experimento informado por Sieblist et al. mostró que el tiempo de mezcla depende críticamente de las condiciones experimentales, en particular de la ubicación de la adición del trazador en el biorreactor. La figura 8 muestra que añadir el trazador cerca de los impulsores tiene un efecto mucho mayor que añadirlo en el punto de control (superficie líquida), lo que reduce el tiempo de mezcla. Esto demuestra la importancia de añadir sustratos y agentes correctores (por ejemplo, bases y antiespumantes) al cultivo cerca de las palas de agitación para que puedan distribuirse rápidamente por todo el cultivo. Las implicaciones de esto se han comprendido durante mucho tiempo; sin embargo, no es una práctica universal.

 English
English français
français Español
Español русский
русский português
português العربية
العربية Deutsch
Deutsch tiếng việt
tiếng việt 한국어
한국어 Türkçe
Türkçe Malay
Malay





